Pengertian Reaksi Eliminasi
Reaksi eliminasi adalah suatu jenis reaksi
organik dimana dua substituen dilepaskan dari sebuah molekul baik dalam satu
atau dua langkah mekanisme. Reaksi satu langkah disebut dengan reaksi E2,
sedangkan reaksi dua langkah disebut dengan reaksi E1. Harap diingat bahwa
simbol angka pada huruf E (yang berarti elimination) tidak melambangkan jumlah
langkah. E2 dan E1 menyatakan kinetika reaksi, yaitu berturut-turut bimolekuler
dan unimolekuler.
Pada
sebagian besar reaksi eliminasi organik, minimal satu hidrogen dilepaskan
membentuk ikatan rangkap dua. Dengan kata lain akan terbentuk molekul tak
jenuh. Hal tersebut memungkinkan sebuah molekul melangsungkan reaksi eliminasi
reduktif, dimana valensi atom pada molekul menurun dua. Jenis reaksi eliminasi
yang penting melibatkan alkil halida, dengan gugus pergi (leaving group) yang
baik, bereaksi dengan basa Lewis membentuk alkena. Perhatikan contoh reaksi
eliminasi berikut ini:

Reaksi
eliminasi adalah kebalikan dari reaksi adisi. Ketika senyawa yang tereliminasi
asimetris, maka regioselektivitas ditentukan oleh aturan Zaitsev.
Reaksi E1 (Alkil Halida)
Reaksi
E1 adalah reaksi eliminasi dimana suatu karbokation (suatu zat antara yang tak
stabil dan berenergi tinggi, yang dengan segera bereaksi lebih lanjut) dapat memberikan
sebuah proton kepada suatu basa dan menghasilkan sebuah alkena. Pada reaksi SN1,
salah satu cara karbokation mencapai produk yang stabil ialah dengan bereaksi
dengan sebuah nukleofil.
Karbokation adalah suatu zat antara yang tak stabil
dan berenergi tinggi. Karbokation memberikan kepada basa sebuah proton dalam
reaksi eliminasi, dalam hal ini reaksi E1 menjadi sebuah alkena.
Tahap 1 (lambat)
Tahap
pertama dalam reaksi eliminasi adalah tahap lambat dan merupakan tahap penentu
laju dari reaksi keseluruhan. Suatu reaksi E1 yang khas menunjukkan kinetika
order-pertama, dengan laju reaksi hanya bergantung pada konsentrasi alkil
halide saja.
Tahap 2 (cepat)
Dalam
tahap dua reaksi eliminasi, basa itu merebut sebuah proton dari sebuah atom
karbon yang terletak berdampingan dengan karbon positif. Elektron ikatan sigma
karbon hidrogen bergeser ke arah muatan positif, karbon itu mengalami
Rehibridisasi dari keadaan sp3 ke
keadaan sp2, dan terbentuklah alkena.
Karena suatu reaksi E1 berlangsung lewat zat antara
karbokation, maka tidak mengherankan bahwa alkil halida tersier lebih cepat
daripada alkil halida lain.
Reaksi E2 (Alkil Halida)
Reaksi
E2 (eliminasi bimolekular) ialah reaksi eliminasi alkil halida yang paling
berguna. Reaksi E2 alkil halida cenderung dominan bila digunakan basa kuat,
seperti–OH dan –OR, dan temperatur tinggi. Secara
khas reaksi E2 dilaksanakan dengan memanaskan alkil halida dengan K+ -OH
/ Na+ -OCH2CH3 dalam
etanol.
Reaksi
E2 berjalan tidak lewat suatu karbokation sebagai zat-antara, melainkan
berupa reaksi serempak (concerted reaction) yakni
terjadi pada satu tahap, sama seperti reaksi SN2.
- Basa
membentuk ikatan dengan hidrogen
- Elektron-elektron
C-H membentuk ikatan pi
- Brom
bersama sepasang elektronnya meninggalkan ikatan sigma C-Br.
Persamaan
diatas menunjukkan mekanisme, dengan anak panah bengkok menyatakan “pendorongan
elektron” (electron-pushing). Struktur keadaan transisi dalam reaksi
satu tahap ini adalah :
Dalam
reaksi E2, seperti dalam reaksi E1, alkil halida tersier bereaksi paling cepat
dan alkil halida primer paling lambat. (Bila diolah dengan suatu basa, alkil
halide primer biasanya begitu mudah bereaksi substitusi, sehingga sedikit
alkena terbentuk).
- Efek
isotop kinetik
Sekelumit bukti eksperimen yang membantu orang
memahami mekanisme E2 ialah perbedaan dalam laju eliminasi antara alkil halide
berdeuterium dan tak berdeuterium. Perbedaan dalam laju reaksi antara senyawa
yang mengandung isotop yang berbeda disebut efek isotop kinetik.
Deuterium
(, atau D) ialah isotop hidrogen yang intinya terdiri dari satu proton dan satu
neutron. Ikatan C-D lebih kuat daripada ikatan C-H sebanyak 1,2 kkal/mol. Telah
dipostulatkan bahwa pemutusan ikatan C-H adalah bagian integral (dari) tahap
penentu laju (satu-satunya tahap) dari suatu reaksi E2. Apa yang terjadi bila H
yang akan tereliminasikan digantikan oleh D? Pemutusan ikatan CD yang lebih
kuat itu meminta lebih banyak energi. Jadi, Eakt harus lebih
tinggi dan laju reaksi eliminasi akan lebih rendah.
Bila
2-bromopropana berikut ini dibiarkan bereaksi E2 dengan CH3CH2O- sebagai
basa, dijumpai bahwa senyawa berdeuterasi hanya dengan 1/7 laju senyawa
2-bromopropana. Fakta ini mendukung mekanisme E2 yang diuraikan di atas.
- Campuran
alkena
Seringkali
reaksi E1 dan E2 dirujuk sebagai eliminasi beta (β). Istilah
ini mencerminkan hidrogen mana yang dibuang dalam reaksi ini. Pelbagai macam
atom karbon dan hidrogen dalam sebuah molekul dapat ditandai dengan α, β, dan
seterusnya, menurut alphabet Yunani. Atom karbon yang mengikat gugus
fungsional utama dalam sebuah molekul disebut karbon alfa (α),
dan karbon berikutnya karbon beta (β). Hidrogen yang terikat pada
karbon α disebut hidrogen-hidrogen α, sementara yang terikat pada karbon β
adalah hidrogen-hidrogen β. Dalam suatu reaksi eliminasi β, sebuah atom
hidrogen β dibuang bila terbentuk alkena. (Tentu saja, alkil halida yang tak
mengandung hidrogen β tak dapat melangsungkan eliminasi β).
Jika
2-bromopropana atau t-butil bromida mengalami eliminasi, hanya akan
diperoleh satu macam produk alkena yang mungkin. Namun bila gugus alkil
disekitar karbon α berlainan terhadap lebih dari satu macam hidrogen β, maka
akan diperoleh lebih dari satu alkena. Reaksi E2 dari 2-bromobutana
menghasilkan dua alkena karena dapat dieliminasi dua macam atom hidrogen:
sebuah hidrogen dari satu gugus CH3 atau sebuah hidrogen dari
sebuah gugus CH2.
- Alkena
mana yang terbentuk ?
Dalam
tahun 1875 seorang ahli kimia Rusia, Alexander Saytseff, merumeskan aturan
berikut, yang sekarang disebut aturan Saytseff: Alkena yang
memiliki gugus alkil terbanyak pada atom-atom karbon ikatan rangkapnya,
terdapat dalam jumlah terbesar dalam campuran produk reaksi eliminasi. Alkena
ini dirujuk sebagai Alkena tersubstitusi lebih-tinggi. Aturan
Saytseff meramalkan 2-butena akan terdapat lebih banyak daripada 1-butena
sebagai produk dalam reaksi E2 dari 2-bromobutana. Hal ini memang terbukti.
Dalam reaksi berikut, campuran alkena terdiri 80% 2-butena dan hanya 20%
1-butena.
Telah
ditetapkan bahwa alkena tersubstitusi-lebih-tinggi lebih stabil
daripada alkena yang tersubstitusi-kurang-tinggi. oleh karena itu
eliminasi E2 menghasilkanalkena yang lebih stabil.
Untuk
memahami mengapa alkena yang lebih stabil (2-butena) lebih disukai daripada
alkena yang kurang stabil (1-butena), hendaknya keadaan transisi yang
menghasilkan kedua butena ini diperhatikan. Dalam masing-masing keadaan
transisi basa sedang merebut proton dan suatu ikatan rangkap sedang terbentuk.
Dikatakan bahwa keadaan transisi memiliki karakter ikatan rangkap, yang dinyatakan
oleh garis titik-titik dalam rumusnya.
Karena
kedua keadaan transisi yang menghasilkan alkena ini memiliki karakter
ikatan-rangkap, maka keadaan transisi yang menghasilkan alkena yang lebih
stabil, juga lebih distabilkan dan memiliki energy yang lebih rendah. Reaksi
yang keadaan transisinya berenergi lebih rendah, akan berlangsung dengan lebih
cepat; oleh karena itu alkena yang lebih stabil merupakan produk yang lebih
berlimpah.
Alkena-alkena trans lebih
melimpah sebagai produk reaksi E2, karena lebih stabilnya keadaan transisi.
Persamaan berikut ini menunjukkan hasil reaksi E2 dari 2-bromopentana.
- Stereokimia
suatu reaksi E2
Dalam keadaan transisi suatu reaksi eliminasi E2,
basa yang menyerang dan gugus yang pergi umumnya sejauh meungkin, atau anti. Karena
inilah maka eliminasi E2 seringkali dirujuk sebagai anti-eliminasi.
Ciri
yang menarik mengenai anti-eliminasi ialah bahwa peletakan-anti dari
H dan Br yang akan dibuang menentukan stereokimia alkena sebagai produk. Untuk
memahami terjadinya hal ini, perhatikan reaksi E2 dari beberapa halide
stereoisomerik. Senyawa 1-bromo-1,2-difenilpropana mempunyai dua atom karbon
kiral (karbon 1 dan 2) dan empat stereoisomer.
Karena
terdapat hanya satu hidrogen β dalam halida awal, maka stereoisomer yang manapun
akan menghasilkan C6H5(CH3)C CHC6H5.
Namun dalam produk ini dapat terjadi keisomeran geometrik.
Bila
atau (1R,2R)-1-bromo-1,2-difenilpropana ataupun (1S,2S)-enantiomernya
menjalani reaksi E2, akan terbentuk (Z)-alkena secara eksklusif;
tak akan terbentuk (E)-alkena.
Mengapa
hanya terbentuk produk (Z) dan tak ada produk (E)?
Karena hanya ada satu konformasi dari masing-masing enantiomer inti di mana Br
dan hidrogen β berposisianti, baik dari enantiomer (1R,2R) maupun
dari enantiomer (1S,2S). Dalam masing-masing enantiomer ini
pelurusan anti- antara H dan Br akan menaruh gugus-gugus fenil
pada satu sisi dari molekul, sehingga dihasilkan (Z)-alkena.
Seandainya eliminasi dapat terjadi tanpa memperdulikan konformasi enantiomer-
enantiomer ini, pastilah akan dijumpai pula (E)-alkena.
Keadaan
tepat terbalik pada enantiomer-enantiomer (1R,2S) atau (1S,2R).Masing-masing
enentiomer ini justru menghasilkan (E)-alkena, dan tak ada (Z)-alkena.
Alasannya sekali lagi, ialah hanya ada satu konformasi dalam mana Br dan
satu-satunya H β itu berposisi anti satu terhadap yang lain.
Dalam konformasi ini gugus-gugus fenil berada dalam sisi-sisi yang berlawanan.
Suatu
reaksi dimana stereoisomer yang berlainan dari pereaksi menghasilkan produk
yang secara stereoisomerik berlainan, disebut reaksi
stereospesifik. Reaksi E2 adalah suatu contoh reaksi stereospesifik.
Halosikloalkana
seperti klorosikloheksana dapat juga bereaksi E2. Dalam kasus-kasus ini,
konformasi cincin memainkan peranan penting dalam jalannya reaksi. Agar berposisi anti dalam
suatu cincin sikloheksana, gugus pergi (seperti klor) dan suatu H β, garuslah
1,2-trans dan diaksial. Tak ada konformasi lain
yang meletakkan H dan Cl inianti satu terhadap yang lain. Meskipun
konformasi ini bukan konformasi favorit, beberapa persen molekul
halosikloalkana berada dalam konformasi ini pada suatu saat dan dengan demikian
dapat menjalani eliminasi.
Mekanisme E2
E2 merupakan reaksi eliminasi bimolekuler.
Reaksi E2 hanya terdiri dari satu langkah mekanisme dimana ikatan karbonhidrogen
dan karbonhalogen terputus membentuk ikatan rangkap C=C. Reaksi E2
dilangsungkan oleh alkil halida primer dan sekunder. Reaksi ini hampir sama
dengan reaksi SN2. Reaksi E2 secara khusus menggunakan basa kuat untuk menarik
hidrogen asam dengan kuat. Perhatikan gambar berikut:
Suatu basa
kuat digunakan untuk menarik hidrogen asam
Mekanisme E1
E1 merupakan reaksi eliminasi unimolekuler. E1
terdiri dari dua langkah mekanisme yaitu ionisasi dan deprotonasi. Ionisasi
adalah putusnya ikatan karbonhalogen membentuk intermediet karbokation. Reaksi
E1 biasanya terjadi pada alkil halida tersier. Reaksi ini berlangsung tanpa
kuat, melainkan dengan basa lemah (dalam suasana asam dan suhu tinggi). Reaksi
E1 mirip dengan reaksi SN1, karena sama-sama menggunakan intermediet
karbokation. Perhatikan dua langkah reaksi E1 berikut ini:
Langkah 1 (ionisasi)
Langkah 2
(deprotonasi)
PERMASALAHAN :
Bagaimana alkena terbentuk pada reaksi E1 ?
Mohon bantuaannya :-)

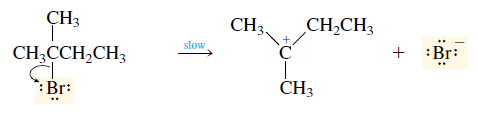



assalamualaikum wr.wb. nama saya fitri khairati (rsa1c114014) saya akan memmbantu menjawab permasalahan saudari ratia. menurut saya Reaksi E1 adalah reaksi eliminasi dimana suatu karbokation (suatu zat antara yang tak stabil dan berenergi tinggi, yang dengan segera bereaksi lebih lanjut) dapat memberikan sebuah proton kepada suatu basa dan menghasilkan sebuah alkena. Pada reaksi SN1, salah satu cara karbokation mencapai produk yang stabil ialah dengan bereaksi dengan sebuah nukleofil. Karbokation adalah suatu zat antara yang tak stabil dan berenergi tinggi. Karbokation memberikan kepada basa sebuah proton dalam reaksi eliminasi, dalam hal ini reaksi E1 menjadi sebuah alkena. semoga jawabannya membantu. wassalamualaikum
BalasHapusHai ratia fw saya fitri mendalina situmorang dengan nim RSA1C114005 akan mencoba membantu memecahkan permasalahan saudari
BalasHapusPada sebagian besar reaksi eliminasi organik minimal satu hydrogen dilepaskan membentuk ikatan rangkap dua . dengan kata lain, akan terbentuk molekul tak jenuh. Hal tersebut memungkinkan sebuah molekul melangsungkan reaksi eliminasi reduktif dimana valensi atom pada molekulmenurun dua jenis reaksi eliminasi yang oenting melibatkan alkil halide dengan gugus pergi (leaving group)yang baik bereaksi dengan basa lewis membentuk alkena.
Semoga membantu :)
Saya Vicaria adelina (RRA1C114004) akan mencoba membantu permasalahan saudari .
BalasHapusMenurut literature yang say a baca , Reaksi E1 (Alkil Halida)
Reaksi E1 adalah reaksi eliminasi dimana suatu karbokation (suatu zat antara yang tak stabil dan berenergi tinggi, yang dengan segera bereaksi lebih lanjut) dapat memberikan sebuah proton kepada suatu basa dan menghasilkan sebuah alkena. Pada reaksi SN1, salah satu cara karbokation mencapai produk yang stabil ialah dengan bereaksi dengan sebuah nukleofil.
Karbokation adalah suatu zat antara yang tak stabil dan berenergi tinggi. Karbokation memberikan kepada basa sebuah proton dalam reaksi eliminasi, dalam hal ini reaksi E1 menjadi sebuah alkena.
Tahap 1 (lambat)
Tahap
Pertama dalam reaksi eliminasi adalah tahap lambat dan merupakan tahap penentu laju dari reaksi keseluruhan. Suatu reaksi E1 yang khas menunjukkan kinetika order-pertama, dengan laju reaksi hanya bergantung pada konsentrasi alkil halide saja.
Tahap 2 (cepat)
Dalam tahap dua reaksi eliminasi, basa itu merebut sebuah proton dari sebuah atom karbon yang terletak berdampingan dengan karbon positif. Elektron ikatan sigma karbon hidrogen bergeser ke arah muatan positif, karbon itu mengalami
Rehibridisasi dari keadaan sp3 ke keadaan sp2, dan terbentuklah alkena.
dapat di lihat pada : http://yulliya.blogspot.co.id/2012/05/reaksi-eliminasi.html
semoga membantu